过氧化氢是什么?怎么分解的?
过氧化氢分解的化学方程式:
2H₂O₂==2H₂O+O₂(等号上写催化剂)
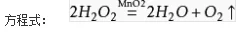
过氧化氢化学式为H₂O₂,俗称双氧水。外观为无色透明液体,是一种强氧化剂,其水溶液适用于医用伤口消毒及环境消毒和食品消毒。在一般情况下会分解成水和氧气,但分解速度极其慢,加快其反应速度的办法是加入催化剂——二氧化锰或用短波射线照射。
水溶液为无色透明液体,溶于水、醇、乙醚,不溶于苯、石油醚。
纯过氧化氢是淡蓝色的粘稠液体,熔点-0.43 °C,沸点150.2 °C,纯的过氧化氢其分子构型会改变,所以熔沸点也会发生变化。凝固点时固体密度为1.71g/,密度随温度升高而减小。它的缔合程度比H₂O大,所以它的介电常数和沸点比水高。纯过氧化氢比较稳定,加热到153 °C便猛烈的分解为水和氧气,值得注意的是,过氧化氢中不存在分子间氢键。
过氧化氢对有机物有很强的氧化作用,一般作为氧化剂使用。
为什么过氧化氢容易分解
从化合价角度来说负一价不是氧元素的稳定化合价,所以双氧水易分解。从原电池电动势角度来说,
O2 + 2 H+ + 2e = H2O2 Ψ = 0.682 V
H2O2 + 2 H+ + 2e = 2H2O Ψ = 1.776 V
反应的标准电动势E =1.776-0.682 =1.094 V > 0,也说明双氧水是不稳定体系。
下面分享相关内容的知识扩展:
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。 编号 操作 实验
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。编号
操作
实验现象
①
分别在试管A、B中加入5 mL 5% H 2 O 2 溶液,各滴入2滴1 mol/L FeCl 3 溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。
试管A中不再产生气泡;
试管B中产生的气泡量增大。
②
另取两支试管分别加入5 mL 5% H 2 O 2 溶液和5 mL 10% H 2 O 2 溶液
试管A、B中均未明显见到有气泡产生。
(1)过氧化氢分解的化学方程式为__________________________________________。
(2)实验①的目的是______________________________________________________。实验中滴加FeCl 3 溶液的目的是_________________________________________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是__________________________________(用实验中所提供的几种试剂)。
(4)某同学在50 mL一定浓度的H 2 O 2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最慢的是______________________。
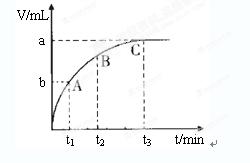
(10分)(1)2H 2 O 2
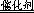
2H 2 O+O 2 ↑(2分)
(2)研究温度对H 2 O 2 分解速率的影响(2分)
加快H 2 O 2 分解速率,使实验现象易于观察(2分)
(3)将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl 3 溶液,观察产生气泡的速率(2分)
(4)C点的即时速率(2分)
试题分析:(1)过氧化氢不稳定,容易分解生成水和氧气,则2H 2 O 2
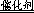
2H 2 O+O 2 ↑;(2)实验①中过氧化氢的浓度和体积相同,氯化铁溶液的浓度和体积也相同,只有反应温度不同,分别是5℃、40℃,根据控制变量设计实验探究的规律,实验①的目的是研究温度对H 2 O 2 分解速率的影响;氯化铁溶液是双氧水分解反应的催化剂,实验中滴加氯化铁溶液的目的加快反应速率,,使实验现象易于观察;(3)实验②中过氧化氢溶液的体积相同,浓度不同,说明该实验的目的是研究浓度对双氧水分解速率的影响,因此其他条件相同即可,为了加快反应速率,便于观察实验现象,改进的 *** 可以是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl 3 溶液,观察产生气泡的速率;(4)随着反应的进行,双氧水的物质的量逐渐减小,其浓度逐渐减小;减小反应物浓度,反应速率减小,则图中A、B、C点所表示的双氧水浓度大小关系为:A>B>C,因此三点表示的瞬时反应速率大小顺序是A>B>C,所以C点所表示的反应速率最慢。
过氧化氢在二氧化锰催化剂的条件下分解制取氧气(写出化学方程式)
化学方程式:2H₂O₂==MnO₂(催化剂)==2H₂O+O₂↑。
过氧化氢(H₂O₂)常被称为“绿色氧化剂”,它和水都是极弱的电解质,但它比水易电离,是一种二元弱酸,在298K时,它的一级电离常数为K=1.55×10-12。
水电离生成H₃O+和OH-叫做水的自偶电离。与水一样,H₂O₂也有极弱的自偶电离。
过氧化氢在常温可以发生分解反应生成氧气和水(缓慢分解),在加热或者加入催化剂后能加快反应,催化剂有二氧化锰、 *** 铜、碘化氢、二氧化铅、三氯化铁、氧化铁,及生物体内的过氧化氢酶等。
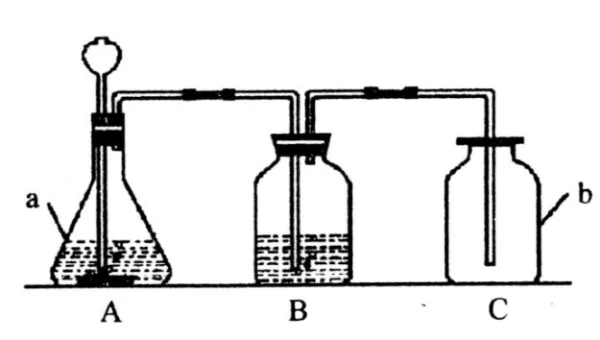
扩展资料
注意事项:
①分液漏斗可以用长颈漏斗代替,但其下端应该伸入液面以下,防止生成的气体从长颈漏斗中逸出;
②导管只需略微伸入试管。
③气密性检查:用止水夹关闭,打开分液漏斗活塞,向漏斗中加入水,水面不持续下降,就说明气密性良好。
④装药品时,先装固体后装液体。
⑤该装置的优点:可以控制反应的开始与结束,可以随时添加液体。
参考资料来源:百度百科-过氧化氢
参考资料来源:百度百科-实验室制氧气
过氧化氢催化分解速率常数的测定反应速率常数与哪些因素有关
七、实验分析与讨论1、开始反应的前段时间,由于反应物混合尚为均匀,反应速率较慢,而导致时间间隔较大;随着反应的进行,反应逐渐趋于稳定,而产生的氧气的量也相对均匀了很多。但是我认为,前段反应时间间隔大的原因还可能是产生的部分氧气要用来填充胶管,而当我们以大约3mL为间隔记录数据时,实际上已反应产生比这个3mL偏大很多的氧气了,当然它相对就要花掉较多一点时间。
2、由t —ln(ⅴ∞-ⅴt)图可以看出,反应前段时间产生约为等体积的氧气时所需的时间也大约一样;但是随着反应的进行,时间的间隔也慢慢地增大。从中可知道,反应速率不仅与温度有关系,而且与反应物的浓度有关,呈正比。
六、思考题
1、读取氧气体积时,量气管及水准瓶中水面处于同一水平面的作用何在?
答:反应开始前量气管里水面所受的压力与水准瓶水面所受的压力是一样的,都是P。反应开始后,由于氧气的产生,水面所受的压力增大而降低。读取氧气体积时,使量气管及水准瓶中水面处于同一水平面,就是继续保持内外的压力相等,有利于准确读取在t时刻产生氧气的体积。
2、用ⅴ∞数据可以计算H2O2的初始浓度c0,如用KMnO4溶液滴定H2O2溶液,求得H2O2的初始浓度c0,再由c0计算ⅴ∞是否可以? 答:可以;
因为KMnO4溶液滴定H2O2溶液时,有以下关系式:2 MnO4-
→5 H2O2→5 O2;当知道滴定KMnO4溶液的浓度和用掉的体积以及被滴定的H2O2溶液的体积,而先求得c0;接着就可根据关系式求得氧气的物质的量;又因为此时可以把氧气当作理想气体,最后就可以根据理想气体方程:PV=nRT,求得V(即ⅴ∞)。
3、H2O2和KI溶液的初始浓度对实验结果是否有影响?应根据什么条件选择它们? 答:有影响;
因为ⅴ∞与H2O2的初始浓度c0成正比,而k又与催化剂KI溶液的浓度成正比,所以说它们对实验结果是有影响的。
应根据量气管的量程大小和反应的快慢程度来选择它们。http://wenku.baidu.com/link?url=E8rHi_yRq6sWFpY1tD5EVSvhEWHLO5D89r8PLB8WCtOyvU0Q4tlicIFEjFqJWaRdfYnbi_gka8N3xLq_Q8RlSsVtLtzjjIJEISe3EKLgf2m







