关于化学平衡的标志
在N2+3H2=2NH3这个反应中,我资料书上说“用不同物质表示反应速率时,某一反应物的速率和某一生成物的速率之比等于化学方程式中相应化学计量数比”,那2V正(H2)=3V正(NH3)能表示达到平衡吗? 另外如果用2v正(H2)=3V逆(NH3)来表示,是不是遵循资料...
N2+3H2=2NH3
反应

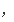
我资料书
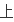
说
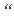
用
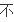
同物质表示反应速率
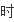
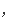
某

反应物

速率

某


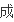
物

速率
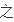
比等于化

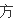
程式

相应化

计量数比
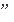
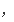
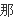
2V

(H2)=3V

(NH3)能表示达

平衡

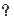
另外

2V

(H2)=3V

(NH3)

要反应都满足
2v

(H2)=3V逆(NH3)


平衡才满足
看

否平衡

看

种物质

消耗量

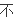

等于
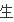
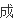
量即V

=V逆
2v

(H2)=3V逆(NH3)描述



V

=V逆
补充:
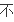

定
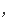
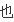

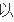
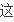
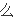
写v

(H2)=3V逆(N2)

要


=逆


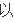

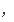

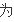
v

(H2)=3V逆(N2)

同
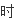
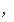
V

(H2)=V逆(H2)
化学平衡的标志都有哪些
同一物质:该物质的生成速率等于它的消耗速率。不同的物质:速率之比等于化学方程式中的化学计量数之比,但必须是不同方向的速率。可逆反应的正、逆反应速率不再随时间发生变化。化学键断裂情况等于化学键生成情况:对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。对不同物质而言,与各物质的化学计量数和分子内的化学键多少有关。下面分享相关内容的知识扩展:
n2 + 3h2 64 2nh3 常温下化学平衡常数是多少
(1)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,平衡常数计算表达式为=c 2(NH 3)c 3(H 2)×c(N 2);故答案为:c 2(NH 3)c 3(H 2)×c(N 2);(2)依据图表数据分析,温度升高,平衡常数减小,则平衡逆向进行,反应是放热反应,故答案为:放热;(3)平衡标志最根本的依据是正反应速率等于逆反应速率,反应混合物中各组分的含量保持不变;a、混合气体中c(N2)不变,则说明达平衡,故a符合;b、c(N2)=c(H2)=c(NH3),只能说明反应某一时刻,不能说明反应达到平衡,故b不符合;c.速率之比等于系数之比,2VH2(正)=3VNH3(逆),说明氨气的正反应速率等于氨气的逆反应速率,反应达到平衡,v正(H2)=v逆(NH3)不能说明反应达到平衡,故c不符合;d.溶器内压强保持不变,反应前后气体体积减小,压强不变,说明平衡不变,故d符合;e.容器内N2、H2、NH3的物质的量之比1:3:2,只能说明反应某一时刻,不能说明反应达到平衡,故e不符合;f.单位时间消耗0.1moN2相当于生成0.2mol NH3同时消耗0.2mol NH3,说明氨气的正反应速率等于氨气的逆反应速率,反应达到平衡,故f符合;故答案为:a、d、f;(4)a、及时分离出NH3气体平衡向右移动,但反应速率减小,故错误; b、适当升高温度反应速率增大但平衡向逆反应方向移动,故错误;c、增大H2的浓度反应速率增大,且该反应向正反应方向移动,故正确; d、选择高效的催化剂能增大反应速率,但平衡不移动,故错误;故选c.如何判断某化学反应是否以达平衡
一、化学平衡状态的判断:具体表现为“一等六定”:一等:正逆反应速率相等;
六定:① 物质的量一定,② 平衡浓度一定,③ 百分含量保持一定,④ 反应的转化率一定,⑤ 产物的产率一定,⑥ 正反应和逆反应速率一定.
除了上述的“一等六定”外,还可考虑以下几点:
①同一物质单位时间内的消耗量与生成量相等.
②不同物质间消耗物质的量与生成物质的量之比符合化学方程式中各物质的化学计量数比.
③在一定的条件下,反应物的转化率更大,或产物的产率更大.
④对于有颜色变化的可逆反应,颜色不再改变时.
对于反应前后气体总体积变的可逆反应,还可考虑以下几点:
①反应混合物的平均相对分子量不再改变.
②反应混合物的密度不再改变.
③反应混合物的压强不再改变.
还可以从化学键的生成和断裂的关系去判断是否处于化学平衡状态.
二、化学平衡状态的标志
1、等速标志:
指反应体系中用同一种物质来表示的正反应速率和逆反应速率相等.
即 V(正)= V(逆)
2、各组分浓度不变标志:
因为V(正)= V(逆)≠0,所以在同一瞬间、同一物质的生成量等于消耗量.总的结果是混合体系中各组成成分的物质的量、质量、物质的量浓度;各成分的体积分数、质量分数;转化率等不随时间变化而改变.
3.有气体参与的可逆反应:
(1)从反应混合气体的平均相对分子质量(M)考虑:M=m(总)/n(总)
①若各物质均为气体:
当气体△n(g)≠0时,若M一定时,则标志达平衡.如2SO2(g)+O2(g) 2SO3(g)
当气体△n(g)=0时,若M为恒值,无法判断是否平衡.如H2(g)+I2(g) 2HI(g)
②若有非气体参加:无论△n(g)≠0或△n(g)=0时,当若M一定时,则标志达平衡. 如C(s)+O2(g) CO2(g)、CO2(g)+ C(s) 2CO(g)
(2)从气体密度考虑:密度=质量/体积
①若各物质均为气体:
A.恒容:密度总为恒值,不能作为平衡标志.
B.恒压:a. △n(g)=0时,密度总为恒值,不能作为平衡标志.
b. △n(g)≠0时,密度为一定值,则可作为平衡的标志.
②若有非气体参加:
A.恒容:密度为一定值,则可作为平衡的标志.
B.恒压:△n(g)=0时,密度为一定值,则可作为平衡的标志.
(3)从体系内部压强考虑:因为恒温、恒容条件下,n(g)越大,则压强就越大.若各成分均为气体时,只需考虑△n(g).
①△n(g)=0时,则压强为恒值,不能作为平衡标志.
②△n(g)≠0时,当压强为一定值,可作为平衡的标志.
(4)从体系内部温度考虑:
当化学平衡尚未建立或平衡发生移动时,反应总要放出或吸收热量.若为绝热体系,当体系温度一定时,则标志达到平衡.
化学平衡时什么速率为零什么速率不为零
此时两个反应的速率均不为0。化学平衡是一种动态平衡化学反应一般都有正反应和逆反应,尽管此时反应仍在继续,但是总反应速率恰好为0,我们把这个情况称为化学平衡,这在可逆反应中表现得尤为明显,指的是正反应速率与逆反应速率相等的状态,但反应物与生成物的物质的量均不再变化。
所以
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至wnw678@qq.com举报,一经查实,本站将立刻删除。