本文主要探讨了阿伏伽德罗定律,即化学反应速率与反应物浓度的关系。文章从六个方面详细分享了该定律的相关内容,包括定律的定义、实验验证、反应级数、速率常数、反应机理和应用。文章对阿伏伽德罗定律进行,指出该定律对化学反应的研究和工业生产具有重要意义。
一、定律的定义
阿伏伽德罗定律是指,在一定温度下,化学反应速率与反应物浓度成正比,即反应速率随着反应物浓度的增加而增加,反应物浓度越高,反应速率越快。该定律是化学动力学中最基本的定律之一,对于理解化学反应的速率和机理具有重要意义。
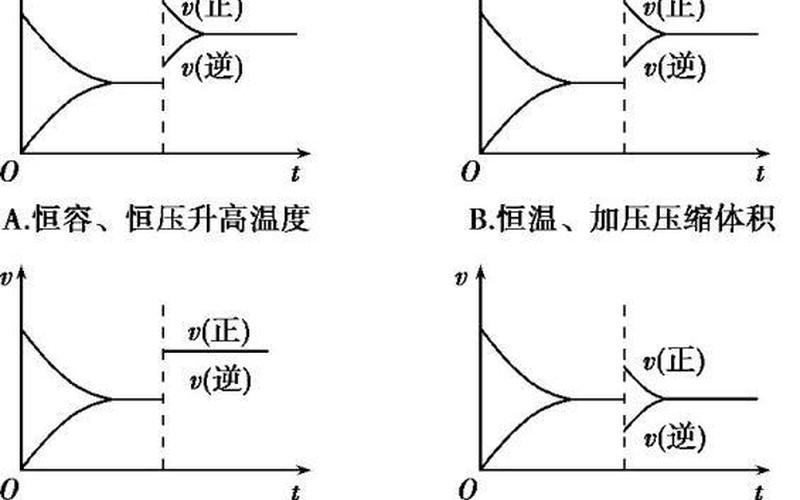
二、实验验证
为了验证阿伏伽德罗定律的正确性,科学家进行了大量的实验研究。其中最著名的是碘化物和过氧化氢的反应实验。实验结果表明,反应速率与碘化物和过氧化氢的浓度成正比,验证了阿伏伽德罗定律的正确性。
三、反应级数
反应级数是指反应中各反应物的浓度对反应速率的影响程度。对于不同的反应,反应级数也不同。阿伏伽德罗定律适用于一级反应和二级反应,而对于高级反应,该定律的适用性就会受到限制。
四、速率常数
速率常数是指在一定温度下,反应物浓度为1mol/L时,反应速率的大小。速率常数越大,反应速率就越快。速率常数的大小与反应物本身的性质、反应物浓度、温度等因素有关。
五、反应机理
反应机理是指反应过程中发生的具体化学变化。阿伏伽德罗定律可以帮助我们理解反应机理,从而进一步研究和掌握化学反应的规律和特性。
六、应用
阿伏伽德罗定律在化学反应的研究和工业生产中有着广泛的应用。例如,在化学反应的动力学研究中,可以通过测量反应速率与反应物浓度的关系来确定反应级数和速率常数。在工业生产中,可以通过控制反应物浓度来调节反应速率,从而实现工业生产的自动化和规模化。
阿伏伽德罗定律是化学动力学中最基本的定律之一,对于理解化学反应的速率和机理具有重要意义。该定律的正确性已经通过大量的实验验证。在具体应用中,阿伏伽德罗定律可以帮助我们确定反应级数和速率常数,掌握反应机理,实现工业生产的自动化和规模化。